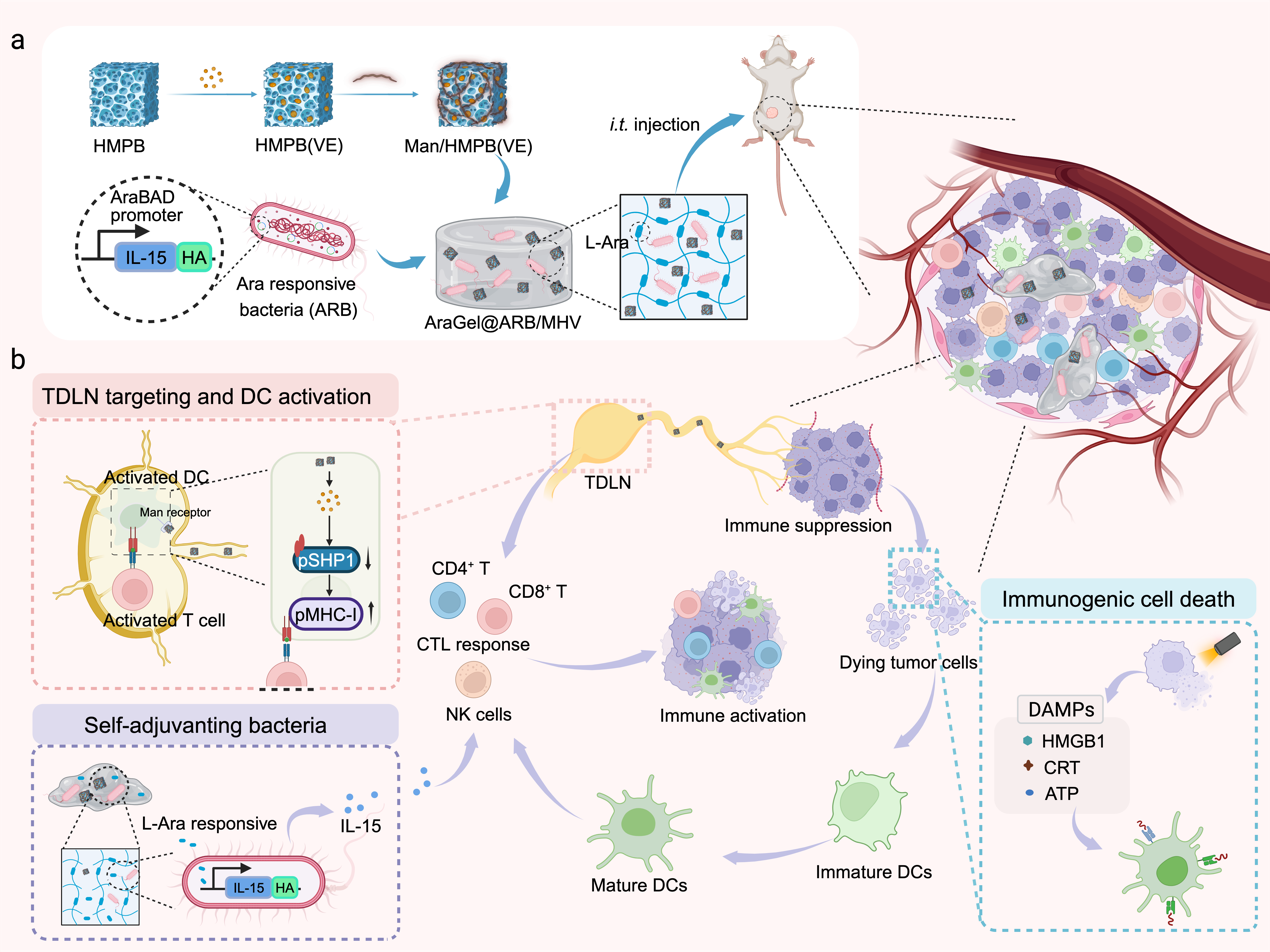
近年来,免疫治疗在癌症治疗中取得了显著进展,但其疗效受到免疫系统协调失调的限制。特别是肿瘤引流淋巴结(TDLNs)在肿瘤免疫反应中的关键作用常常被忽视。TDLNs是树突状细胞(DCs)捕捉和呈递肿瘤抗原的重要场所,能够启动T细胞的激活,从而触发抗肿瘤免疫反应。为了克服免疫治疗中的这一限制,研究人员亟需开发新策略,将TDLNs与肿瘤免疫联合应用,从而增强免疫反应并提高治疗效果。研究表明,维生素E(VE)通过抑制Src同源区2结构域含酪氨酸磷酸酶1(SHP1)检查点来激活DCs,从而增强抗肿瘤免疫反应并提高T细胞活性。因此,靶向抑制SHP1被认为是增强肿瘤免疫反应的一个有效策略。

诱导小鼠BMDCs的操作步骤
实验材料
实验步骤
取适当周龄的C57BL/6健康雌鼠,颈椎脱臼处死后浸泡于75%的酒精中,放入超净工作台中表面灭菌15 min。剪下双侧腿骨保留髋关节和踝关节,去除胫骨和股骨表面皮肤及肌肉组织;
按照75%乙醇-PBS-无血清RPMI1640培养基顺序洗涤后,剪断胫骨和股骨露出骨髓。使用1 ml无菌注射器吸取无血清RPMI1640 培养基冲洗骨髓腔,直至骨髓发白;
收集的细胞悬液经70 μm无菌滤网过滤,在4 ℃条件下1000 rpm离心5 min,弃上清;
沉淀中加入3 ml红细胞裂解液,静置3 min,加入9 ml无血清RPMI1640培养基终止裂红,4 ℃条件下1000 rpm离心5 min,弃上清;
使用含GM-CSF和IL-4的完全培养基培养。在第2、4、6 天半量换液,在第7天收集诱导后的BMDCs用于后续实验。流式细胞术检测CD11c阳性细胞的百分比,确认诱导效果。
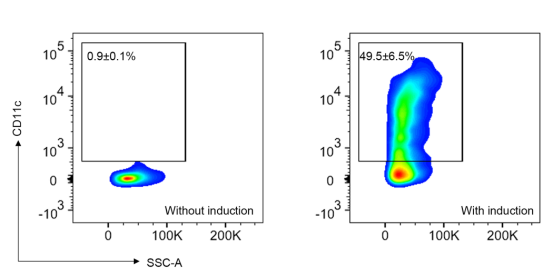
在使用GM-CSF和IL-4诱导7天后的骨髓来源细胞中,CD11c阳性细胞的百分比。
